医療機器には、メスや体温計のような小物類、体内で使用するペースメーカー、CTなどの大型のものまで多岐にわたります。当社では、医療機器について、申請に必要な細胞毒性試験、感作性試験、刺激性試験などの安全性試験を医療機器GLP基準で実施しています。
小物医療機器
体内埋込医療機器
大型医療機器
開発フロー
下記フローは開発例です。個別の開発ケースに応じ異なる場合があります。詳細は当社営業部までお問い合わせください。
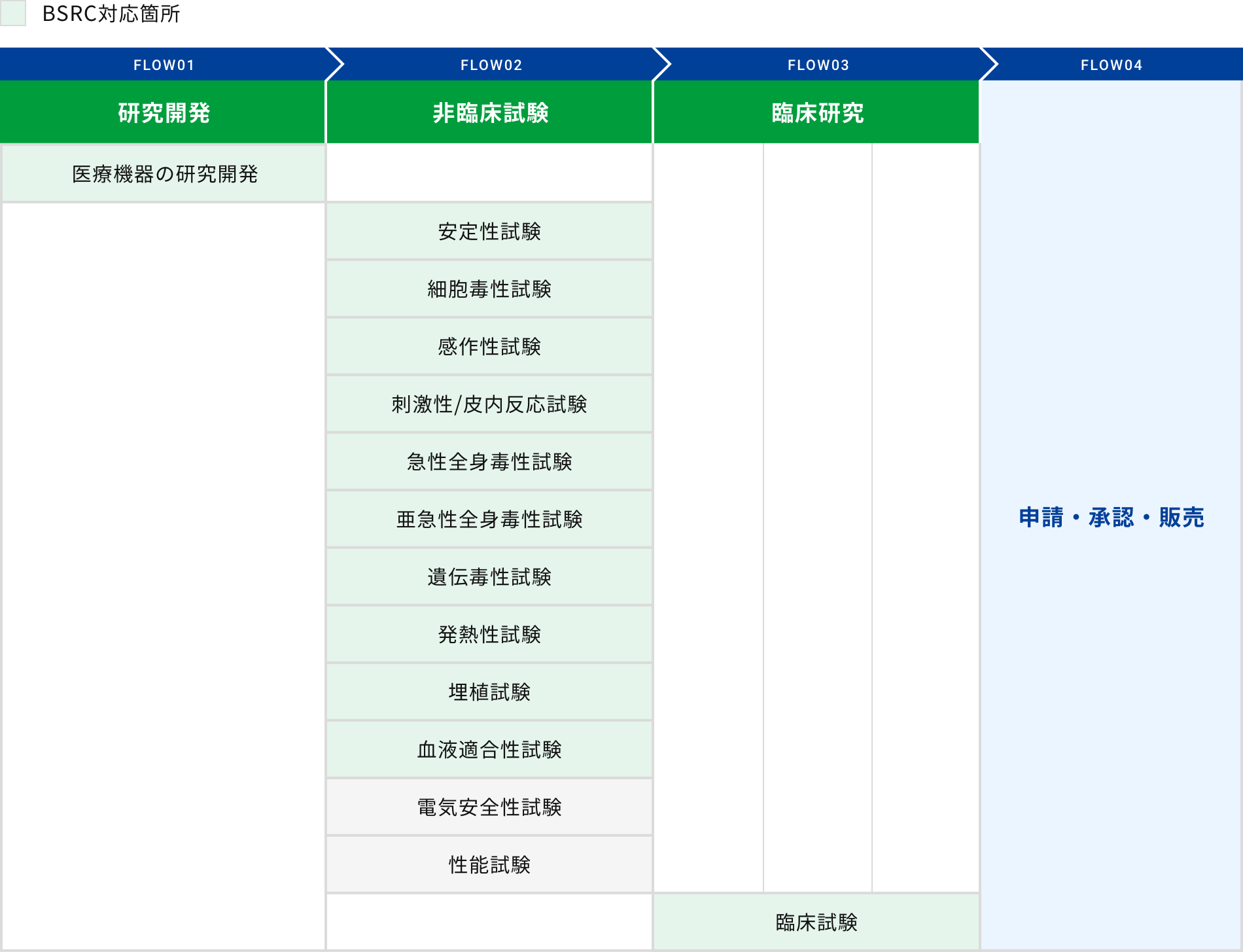
対応試験について
当社では幅広い安全性試験の実施が可能です。試験動物種はげっ歯類、サルなど種類も豊富です。長年培ったストラテジーでお客様のご要望にお応えいたします。また、モデル動物を用いたin vivo試験、種々の培養細胞を用いたin vitro試験、生物製剤関連試験など、ご要望に応じた試験を提案いたします。ぜひご相談ください。
医療機器の薬事
承認申請区分
医療機器の製造販売承認申請に必要な添付書類についてはその申請区分により異なります。下表に日本における医療機器の承認申請ための申請区分を示しましたので、ご参照ください。
| 新医療機器 | 既に製造販売の承認を受けている医療機器(法第14条の4第1項第1号及び第2号に規定する再審査期間を経過していないものを除く。以下、「既承認医療機器」という。)と構造、使用方法、効能、効果又は性能が明らかに異なる医療機器 |
|---|---|
| 改良医療機器 | 新医療機器等又は後発医療機器のいずれにも該当しない医療機器。すなわち、再審査の指示を受ける対象となるほどの新規性はないが、既存の医療機器と構造、使用方法、効能、効果又は性能が実質的に同等でないもの |
| 後発医療機器 | 既承認医療機器と構造、使用方法、効能、効果及び性能が同一性を有すると認められる医療機器。すなわち、既承認医療機器と構造、使用方法、効能、効果及び性能が実質的に同等であるもの |
平成21年3月27日付け医薬食品局長通知(薬食発第0327006号)


















